 |
Partie III :
Caractérisation
des échantillons et attribution des résonances
Les conditions d’une étude par Résonance Magnétique Nucléaire nécessitent de disposer d’un échantillon homogène, hautement concentré (de l’ordre de 1 mM dans 0,5 mL) et stable dans le temps (plusieurs semaines à température ambiante). Le plus souvent, cet échantillon est enrichi en isotopes 15N et/ou 13C afin de bénéficier des propriétés de spin 1/2 de ces noyaux. L’obtention d’un tel échantillon se fait généralement par surproduction de la protéine dans une bactérie génétiquement modifiée et alimentée exclusivement en substrats isotopiquement marqués. Pour des raisons de coût de ces nutriments (ammonium–15N, glucose–13C), les milieux de culture utilisés contiennent des concentrations minimales de substrats et la croissance bactérienne n’est pas optimale. Lorsque le rendement est suffisant, se pose ensuite le problème de la solubilité de la protéine. Si la protéine n’a pas le temps de se replier correctement lors de sa synthèse, elle peut apparaître sous forme de corps d’inclusion qu’il faudra resuspendre. Une ou plusieurs étapes de purification sont ensuite nécessaires pour isoler la protéine d’intérêt des autres constituants. Cette étape est facilitée lorsque la séquence protéique est étiquetée par génie génétique, par exemple à l’aide d’une séquence poly–histidine (d’affinité élevée pour le nickel ou le cobalt). La protéine purifiée doit alors être concentrée sans dépasser le seuil où elle précipitera. Le choix du pH et de la force ionique conditionne également la solubilité de la protéine. Au cours de l’ensemble de ce processus, il est possible que la protéine soit coupée par des protéases ou encore qu’elle soit oxydée. C’est pourquoi on ajoute en général, au cours de la préparation, des composés anti-protéases et/ou anti-bactériens (azoture de sodium NaN2) et que l’on scelle souvent les tubes de RMN sous atmosphère inerte (argon).
La protéine TolA d’Escherichia coli comporte 421 résidus et est constituée de trois domaines (Levengood et al., 1991). Le domaine N-terminal (TolA-I : résidus 1 à 47) est ancré dans la membrane cytoplasmique ; il est relié au domaine C-terminal (TolA-III : résidus 311 à 321) par l’intermédiaire d’une hélice alpha (TolA-II : résidus 48 à 310).
Notre étude par RMN porte sur le domaine C-terminal de TolA (TolAIII). Trois constructions différentes ont été nécessaires avant d’obtenir un échantillon concentré stable et homogène, convenable pour une étude par RMN. Les séquences correspondantes sont représentées sur la figure 18.


La numérotation utilisée dans les études de RMN est celle de TolAIII3 lorsque les numéros sont inférieurs ou égaux à 106. Sinon, il s’agit de la numérotation dans la protéine TolA entière.
Sauf mention contraire, les expériences de RMN ont été enregistrées avec un pH de 6.8 à 27°C sur un spectromètre Varian Inova (800 MHz). Typiquement, le tampon utilisé était composé de KPO4 (50 mM) et de NaF (50 mM).
La construction TolAIII1 a été utilisée par (Derouiche et al., 1997) dans une étude détaillée de la liaison de TolA avec les domaines de translocation des colicines A et E1. Elle comprend (figure 18) les résidus 290 à 421 de TolA, précédés de la séquence (M)AAHHHHHHRMQ ajoutée pour faciliter la purification du domaine protéique par passage sur billes de cobalt.
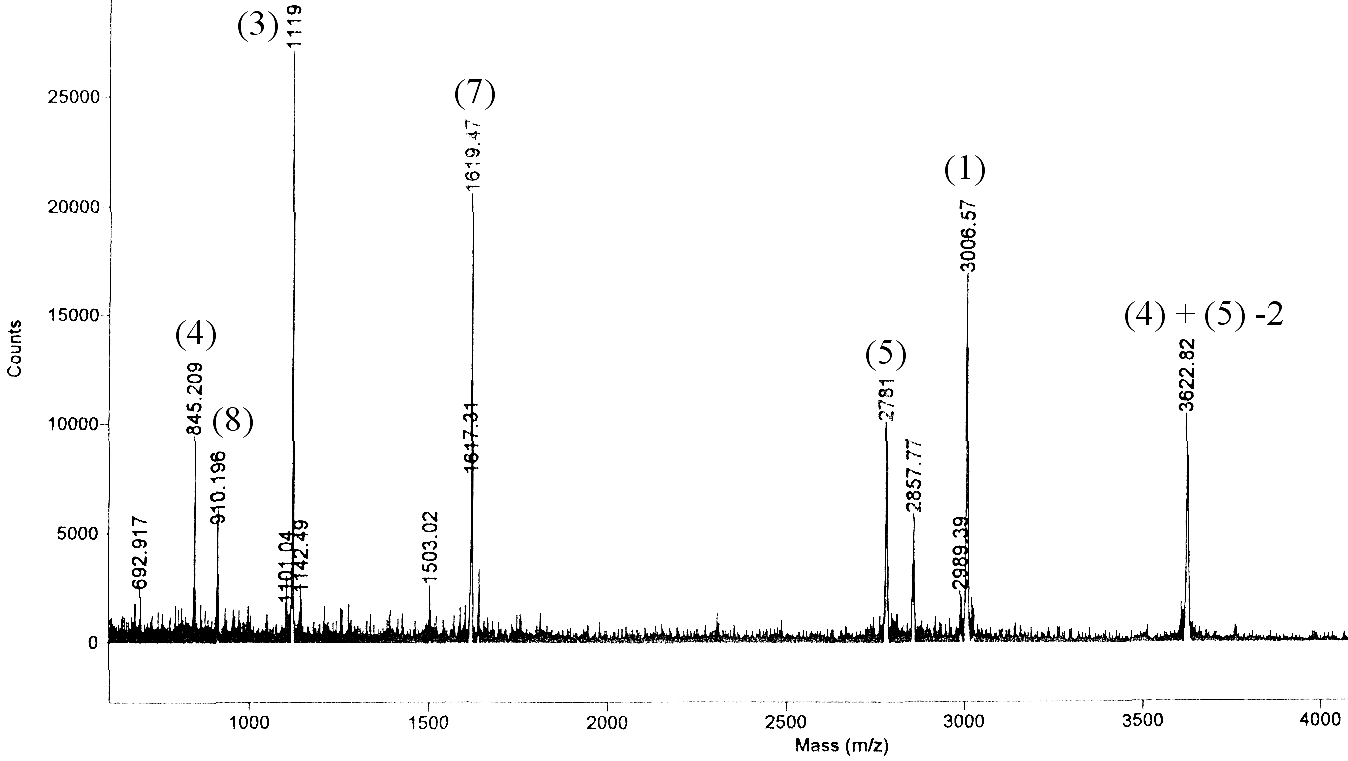
L’analyse par RMN de cet échantillon[23] suggère une forte flexibilité d’une partie du domaine, comme l’indiquent les raies larges au centre[24] d’un spectre HSQC 1H–15N (figure 19).
Figure 19 : Spectre HSQC 1H–15N de TolAIII1 (0,1 mM)
Par ailleurs, l’apparition de résonances au cours du temps rend impossible une étude approfondie de ce domaine par RMN. L’instabilité de cet échantillon au cours du temps peut s’expliquer par des dégradations au niveau de la partie flexible de TolAIII1.
La prédiction des éléments de structure secondaire effectuée sur cette construction suggère que la partie N-terminale de TolAIII1 n’est pas structurée. Par conséquent, une construction plus courte a été envisagée.
La construction TolAIII2 comprend les résidus 329 à 421 de TolA, précédés de la séquence (M)AAHHHHHHRM ajoutée pour faciliter la purification du domaine protéique (figure 18).
Avant de démarrer l’étude structurale de TolAIII2, des expériences de biochimie ont été réalisées[25] pour vérifier que ce domaine plus court restait toujours fonctionnel. Pour cela, une nouvelle construction du domaine N-terminal de la colicine A, possédant une séquence poly-histidine, a été effectuée afin d’améliorer la purification de la protéine. Ce domaine de 177 résidus[26], baptisé ATh, est utilisé dans l’ensemble de ce travail. La liaison du domaine TolAIII2 avec le domaine ATh a été vérifiée par immuno-détection et est comparable à celle de TolAIII1 (constante de dissociation de l’ordre de 0,4 µM)
L’enregistrement d’un spectre de dichroïsme circulaire de TolAIII2 dans la région des ultraviolets lointains indique que l’échantillon possède une structure secondaire.
Sur un spectre HSQC 1H–15N enregistré sur cet échantillon (figure 20), on n’observe plus de pics
larges et la dispersion spectrale est élevée. Cela indique que la
construction TolAIII2 possède une structure tertiaire stable. On
relève 160 pics de corrélation correspondant à des
liaisons N-H primaires, ce qui dépasse de très loin les 94
attendus (103 résidus dont 8 de proline). Le
nombre de pics élevé indique une multiplicité de
conformations (ou de configurations).
La validité de la
première de ces hypothèses a pu être testée par
spectrométrie de masse. L’enregistrement d’un spectre MALDI
de TolAIII2 montre que le résidu de méthionine N-terminal est
correctement coupé et que l’échantillon ne subit pas de
dégradation (protéolyse, oxydation de méthionine) au cours
du temps. Par conséquent, l’échantillon
étudié est homogène du point de vue de sa séquence. L’hétérogénéité
observée peut alors s’expliquer (1) par la présence ou
l’absence d’un pont disulfure reliant les deux résidus de
cystéine Cys42 et Cys67, (2) par une ou plusieurs isomérie(s)
cis/trans de liaison peptidique[27] ou
éventuellement (3) par des repliements différents du domaine.
Figure 20 : Spectre HSQC 1H–15N de TolAIII2 (0,5 mM)
L’état d’oxydation des résidus de cystéine a été testé par spectrométrie de masse. La mesure directe de la masse du domaine par spectrométrie MALDI est trop peu précise (1‰) pour discriminer directement les deux protons des résidus de cystéine. En revanche, la digestion de TolAIII2 par l'endoprotéase LysC, suivie d'une analyse de la masse des fragments permet de répondre à la question de la présence d'un pont disulfure (à condition que les cystéines soient situées sur des fragments distincts). En effet, la présence d'un pont disulfure maintient une liaison covalente entre deux fragments coupés (n°4 et n°5) et on peut observer un pic correspondant à la somme des deux fragments (moins deux protons). Il faut noter qu'une coupure inefficace entre les fragments contenant les résidus de cystéine ne peut être confondue avec la présence d'un pont disulfure car une liaison peptidique fait intervenir un molécule d'eau, donc diminue la masse de 18 daltons. Après attribution des fragments, on observe un pic correspondant aux deux fragments liés par un pont disulfure, mais aussi deux pics correspondant aux mêmes fragments isolés. Ceci indique que les états oxydé et réduit des résidus de cystéine coexistent dans l’échantillon de TolAIII2.
|
(1) |
|
AAHHHHHHRMNNGASGADINNYAGQIK- |
|
3007 |
Da |
|
(2) |
|
-SAIESK- |
|
647 |
Da |
|
(3) |
|
-FYDASSYAGK- |
|
1119 |
Da |
|
(4) |
|
-TCTLRIK-
|
|
844 |
Da |
|
(5) |
|
-LAPDGMLLDIKPEGGDPALCQAALAAAK- |
|
2781 |
Da |
|
(6) |
|
-LAK- |
|
334 |
Da |
|
(7) |
|
-IPKPPSQAVYEVFK- |
|
1620 |
Da |
|
(8) |
|
-NAPLDFKP |
|
911 |
Da |
|
(4) + (5) - 2 Da |
|
Pont Disulfure |
|
3623 |
Da |
|
(4) + (5) - 18 Da |
|
Mauvaise Coupure |
|
3607 |
Da |
Afin de limiter le
nombre d’espèces en solution et de simplifier l’analyse par
RMN, le reste de l’étude de TolAIII2 a été
effectué en présence d’un agent réducteur, le DTT[28]. Ce choix a été guidé
par l’observation d’une meilleure liaison[29] entre ATh et TolAIII2 en milieu
réducteur[30] (Lloubès, communication personnelle).
Les effets du DTT sur l’échantillon ont été
observés par spectrométrie de masse et par RMN. D’une part,
la réduction du pont disulfure est démontrée par la disparition sur le spectre de masse du pic correspondant à la somme des masses des deux fragments contenant des résidus
de cystéine (pic de masse 3622 sur la figure 21). D’autre part, la
disparition d’environ 40 pics du
spectre HSQC 1H–15N permet d'attribuer ces pics à
la forme oxydée du domaine.
Après réduction, il reste toujours un excès de pics (120 contre 94 escomptés), ce qui traduit encore
une hétérogénéité de la forme
réduite, pouvant être due
à des conformations différentes (isomérie(s) cis/trans de
liaison peptidique).
Deux échantillons réduits distincts ont été utilisés pour l’étude de TolAIII2 (l’un pour les expériences d’interactions avec ATh et l’autre pour l’attribution des résonances). Au cours du temps, des spectres HSQC 1H–15N de contrôle ont été enregistrés sur ces échantillons et il a été observé des déplacements d'équilibre entre les deux espèces réduites, gouvernés par des cinétiques très lentes. Dans un des échantillons, une trentaine de pics ont disparu en quelques semaines, indiquant un déplacement d’équilibre vers une forme unique nommée petit ‘r’. Dans l’autre échantillon, le déplacement inverse a été observé en quelques mois vers une forme nommée grand ‘R’. La superposition des spectres des deux échantillons devenus homogènes reconstitue le spectre du mélange (réduit) initial. Les conditions biochimiques des deux échantillons sont décrites ci-dessous. Ce phénomène remarquable reste inexpliqué.
|
Echantillon : |
pour interactions |
pour attribution |
|
|
[ TolA-III ] |
0,2 mM |
0,5 mM |
|
|
[ D20 ] |
10% |
||
|
[ Na Cl ] |
50 mM |
500 mM |
|
|
[NH4Cl] |
0,2 mM |
0 |
|
|
[ Na PO4 ] |
50 mM |
||
|
pH |
6,8 |
||
|
Cocktail antiprotéase |
Complete x1 (Boehringer Mannheim) |
||
|
[ DTT ] |
> 10 mM |
||
|
Atmosphère |
argon |
||
|
Orifice du tube |
fermé avec Parafilm |
scellé |
|
|
Température de stockage |
Température ambiante |
4° C |
|
|
Déplacement d’équilibre |
R
vers r |
r vers R |
|
|
Durée pour l’équilibre r/R |
20 jours |
4 mois |
|
Tableau 5 : Conditions biochimiques des échantillons de TolAIII2
Afin de mieux approcher les conditions physiologiques du périplasme (milieu oxydant), une troisième construction a été effectuée. Alors que TolAIII1 et TolAIII2 sont produits dans le cytoplasme d’Escherichia coli et extraits du lysat cellulaire, TolAIII3 est produit directement dans le périplasme, grâce à une séquence signal N-terminale. Une partie de la protéine est alors récupérée directement dans le milieu de culture (fragilisation de l’enveloppe), l’autre étant extraite du périplasme après choc osmotique. La protéine TolAIII3 mature comprend les résidus 325 à 421 de TolA, précédés de la séquence AEF et suivis de la séquence polyhistidine HHHHHH (figure 18).
L’enregistrement
d’un spectre de masse (MALDI) montre que le résidu de
méthionine N-terminal est correctement coupé et que
l’échantillon n’a pas subi de dégradation
(protéolyse, oxydation de méthionine).
Sur un spectre HSQC 1H–15N enregistré sur cet échantillon (figure 22), on relève 87 pics, ce qui ne dépasse pas les 97 attendus (106 résidus dont 8 de proline) et suggère l’homogénéité (de séquence et de conformation) de l’échantillon. L’absence de 10 pics s’explique par la dynamique particulière de certains résidus, qui rend les rend invisible (coalescence).
Comme pour TolAIII2, l’état d’oxydation des résidus de cystéine a été testé par spectrométrie de masse et révèle la présence dans TolAIII3 d’un pont disulfure entre les résidus de cystéine Cys42 et Cys67.
Figure 22 : Spectre HSQC 1H–15N de TolAIII3 (0,1 mM)
L’interprétation précise des spectres de RMN requiert au préalable l’attribution de chaque signal de résonance au(x) noyau(x) d’atome correspondant(s).
L’attribution séquentielle des résonances 1H et 15N de la chaîne principale de la protéine TolAIII2 a été réalisée à partir des expériences 3D TOCSY-HSQC et 3D NOESY-HSQC. Le principe d’attribution est décrit dans la partie VII.
L’attribution a débuté sur l’échantillon hétérogène de TolAIII2 réduit à une température[31] de 27 °C. L’attribution de deux séries des résonances pour l’unique paire de résidus glycine-glycine a confirmé la présence de deux conformères. Puis, l’évolution dans le temps de l’échantillon a orienté le travail d’attribution vers la forme R devenue majoritaire. 80 résidus ont pu être identifiés, les autres étant constitués des 8 résidus de proline, des 12 premiers résidus de la séquence et de 3 résidus d’une boucle.
Le marquage supplémentaire au 13C de la protéine accélère le travail d’attribution séquentielle des résonances car il donne accès à une plus grande variété d’expériences de RMN. Dans le cas de TolAIII3, j’ai enregistré un spectre HNCA en plus des spectres 3D TOCSY–HSQC et 3D NOESY–HSQC. Le principe d’attribution est décrit dans la partie VII. 90 résidus ont pu être retrouvés, les autres étant constitués des 8 prolines, des résidus A1, E2, N8, Q85 et H103 à H106.
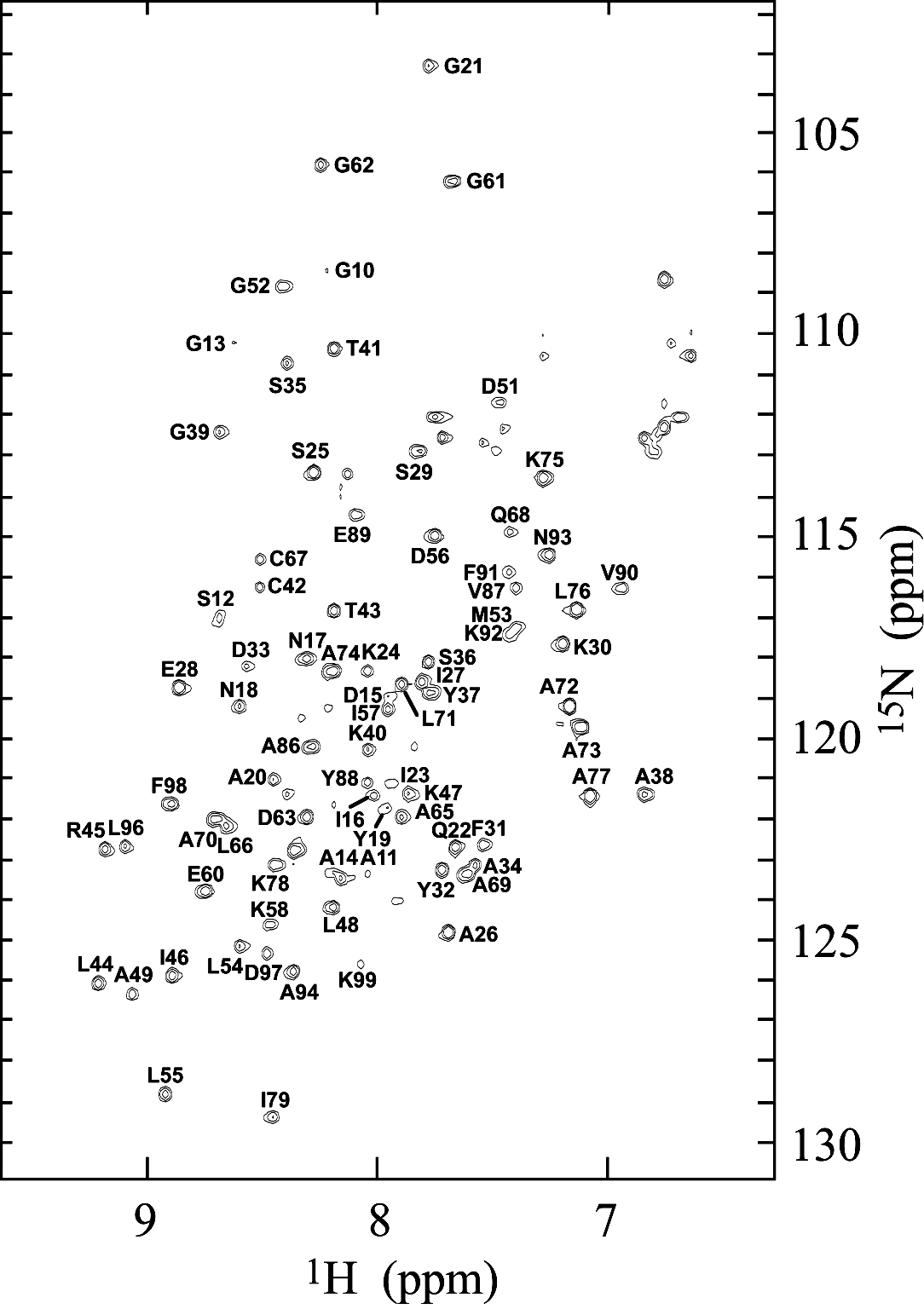
Figure 23 : Spectre HSQC 1H–15N attribué de la forme R de TolAIII2 (0,5 mM)
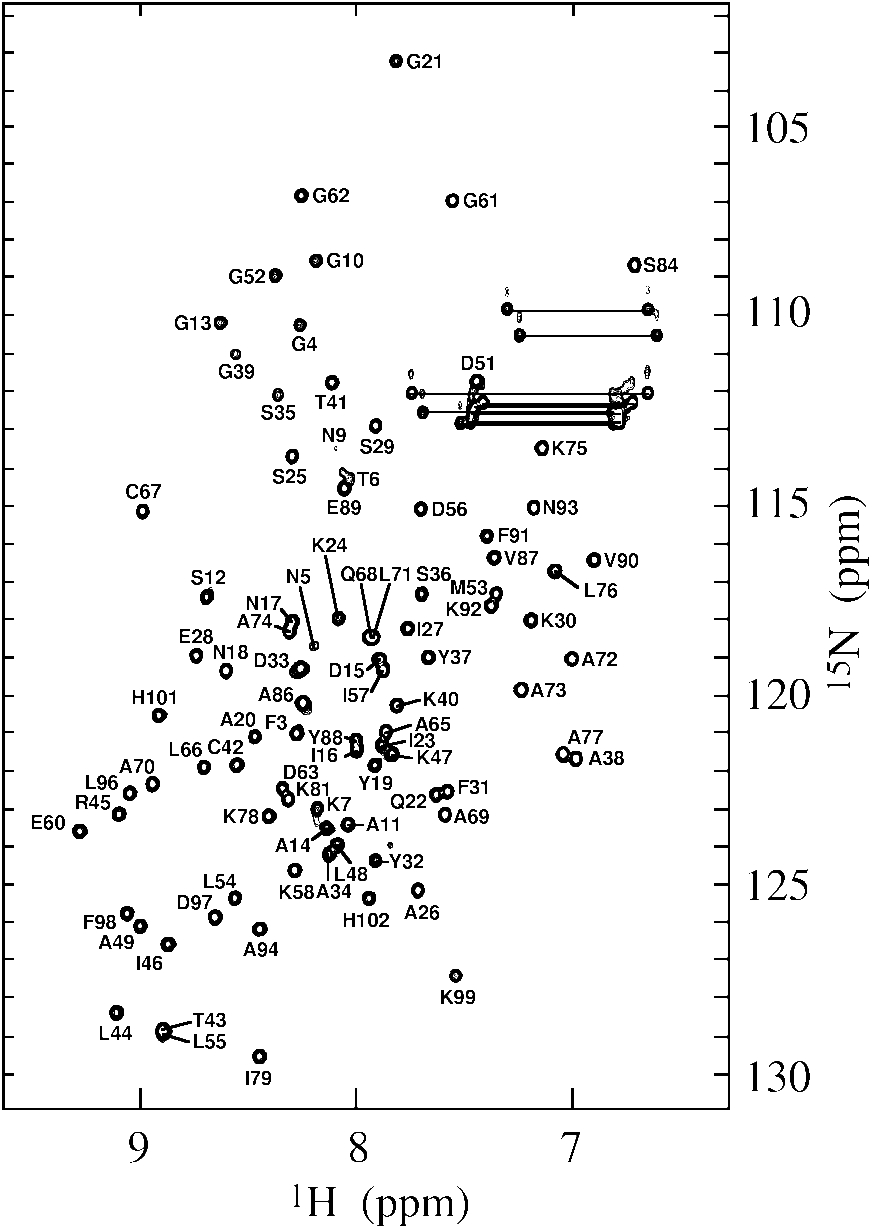
Figure 24 : Spectre HSQC 1H–15N attribué de TolAIII3 (0,2 mM)
Les spectres HSQC 1H–15N de TolAIII2 (réduit) et TolAIII3 (oxydé) ne se superposent pas. Les différences de déplacements chimiques 1H et 15N sont présentés (en valeur absolue) sur la figure 25. On constate sans surprise que les résidus les plus affectés se situent à proximité (dans l’espace) des résidus de cystéine 42 et 67 engagés ou non dans un pont disulfure.
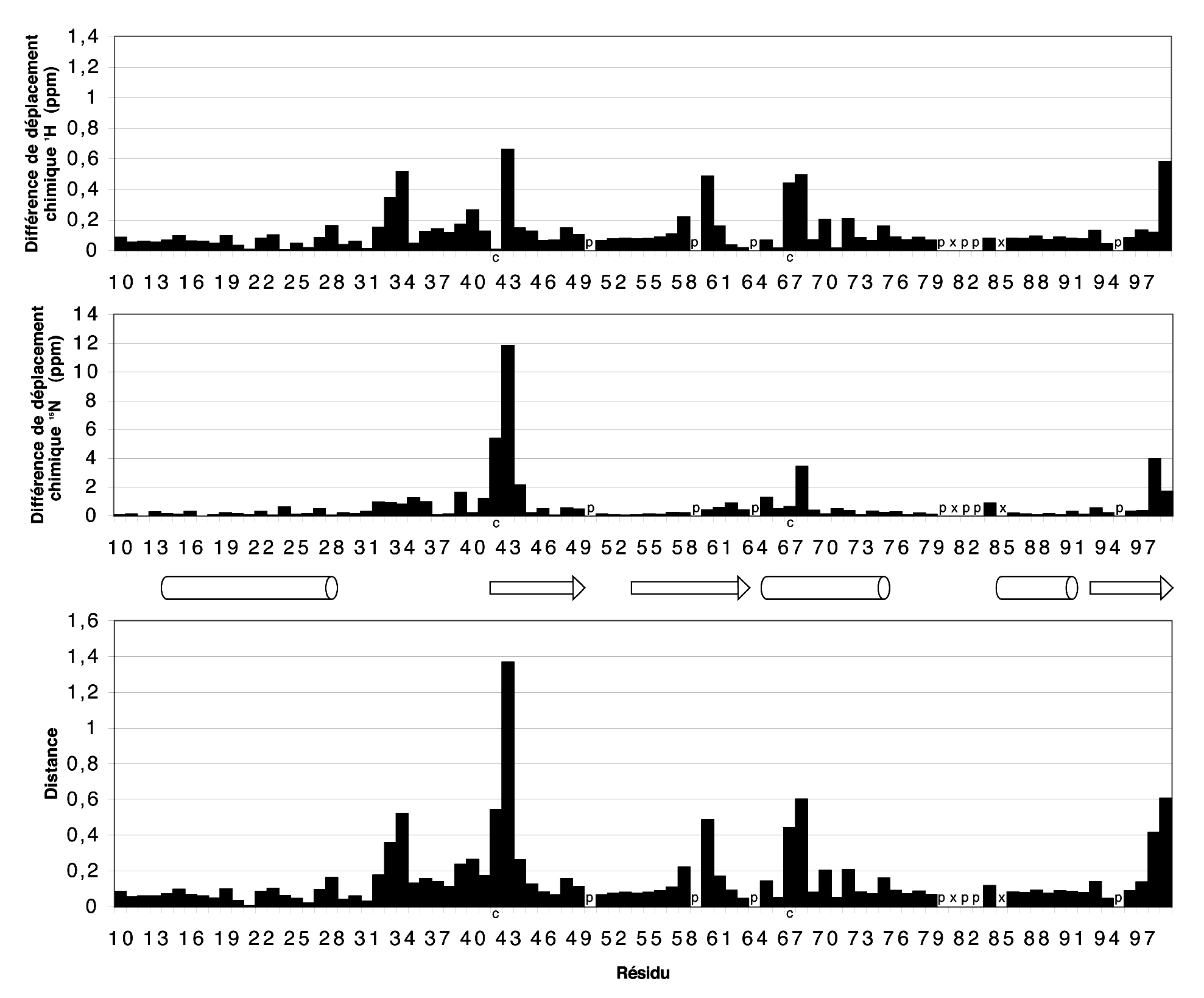
Figure 25 : Différences de déplacements chimiques dans les N–H de la chaîne principale entre TolAIII2 (forme R) et TolAIII3. Les résidus de cystéine, de proline et ceux non-attribués sont indiqués par les lettres c, p et x. En haut : valeur absolue de la différence de déplacements chimiques du proton amide DdH . Au milieu : valeur absolue de la différence de déplacements chimiques de l’azote amide DdN . En bas : distance euclidienne rapportée à l’échelle des déplacements chimiques 1H suivant la formule (où gH et gN représentent les rapports magnétogyriques respectifs de 1H et de 15N) :
Le principe d’attribution dans les chaînes latérales est décrit dans la partie VII.
L’attribution des résonances 1H, 15N et 13C de TolAIII3 a fait l’objet d’une publication dans Journal of Biomolecular NMR (Deprez et al., 2000). La table d’attribution a été déposée dans la base de données BioMagResBank[32] avec l’identifiant BMRB–4771 et est reproduite ci-après.
Le déplacement chimique des Cß des résidus de cystéine est un indicateur de l’état oxydé ou réduit de ces résidus. Ce déplacement chimique est de[33] 28,0 pour un résidu de cystéine réduit et de 41,1 pour un résidu de cystéine oxydé (Wishart et al., 1995). Le déplacement chimique élevé des Cß des résidus de cystéine 42 et 67 de TolAIII3 (respectivement 48,7 et 37,6 ppm) indique leur état oxydé, ce qui confirme la présence d’un pont disulfure entre ces résidus.
Par ailleurs, l’analyse statistique des déplacements chimiques des Ha, Ca, CO et Cß permet de déterminer les éléments de structure secondaire de TolAIII3 (figure 3 de l’article (Deprez et al., 2002) présenté dans la partie suivante ).
Tableau 6 : Attribution des résonances de TolAIII3 à 27 °C, pH=6,8. Les déplacements chimiques des protons portés par les hétéroatomes sont indiqués entre parenthèses. Les déplacements chimiques dégénérés ou manquants sont indiqués par un astérisque.
|
résidu |
N |
C |
C a |
Cß |
autres |
|
A1 |
|
51.77 (3.93) |
19.33 (1.34) |
||
|
E2 |
|
175.87 |
56.25 (4.21) |
30.35 (1.86,1.75) |
Cg , 35.93 (2.08,2.04) |
|
F3 |
121.05 (8.29) |
176.18 |
57.57 (4.55) |
39.58 (3.09,2.93) |
|
|
G4 |
110.28 (8.28) |
173.75 |
45.22 (3.85, *) |
||
|
N5 |
118.80 (8.21) |
53.15 (4.71) |
38.77 (2.69,2.77) |
||
|
T6 |
114.33 (8.04) |
61.95 (4.24) |
69.78 (4.18) |
Cg 2, 21.44 (1.12) |
|
|
K7 |
123.12 (8.20) |
56.18 (4.23) |
32.75 (1.69,1.74) |
Cg , 24.54 (1.33,1.31); Cd , 28.84 (1.58 *); Ce , 41.98 (2.90 *) |
|
|
N8 |
|
176.10 |
54.69 (4.38) |
40.71 (2.72,2.62) |
|
|
N9 |
113.61 (8.12) |
175.54 |
|||
|
G10 |
108.62 (8.21) |
173.56 |
45.03 (3.80,3.89) |
||
|
A11 |
123.47 (8.06) |
177.19 |
51.61 (4.39) |
19.41 (1.21) |
|
|
S12 |
117.44 (8.71) |
175.29 |
57.65 (4.43) |
64.55 (4.07,3.90) |
|
|
G13 |
110.27 (8.65) |
175.75 |
46.92 (3.78,3.92) |
||
|
A14 |
123.55 (8.16) |
173.02 |
54.72 (4.16) |
18.08 (1.33) |
|
|
D15 |
119.29 (7.90) |
177.80 |
56.95 (4.37) |
40.26 (2.75,2.48) |
|
|
I16 |
121.38 (8.02) |
177.22 |
65.31 (3.83) |
38.14 (2.01) |
Cg 1, 29.45 (1.71,1.10); Cg 2, 17.18 (1.04); Cd 1, 13.35 (0.83) |
|
N17 |
118.28 (8.33) |
178.75 |
56.20 (4.49) |
38.17 (2.79, *) |
|
|
N18 |
119.40 (8.63) |
178.11 |
55.92 (4.46) |
38.22 (2.96,2.85) |
|
|
Y19 |
121.83 (7.93) |
177.08 |
61.16 (4.34) |
37.69 (3.00,2.53) |
|
|
A20 |
121.15 (8.49) |
180.30 |
55.54 (3.50) |
17.83 (1.62) |
|
|
G21 |
103.37 (7.84) |
176.62 |
46.89 (3.71,3.94) |
||
|
Q22 |
122.68 (7.65) |
179.70 |
58.84 (4.02) |
28.50 (2.17,1.82) |
Cg , 34.34 (2.53,2.30) |
|
I23 |
121.37 (7.90) |
177.60 |
66.13 (3.23) |
37.69 (1.55) |
Cg 1, 27.01 (0.74,0.23); Cg 2, 17.20 (0.60); Cd 1, 14.46 (0.08) |
|
K24 |
118.03 (8.10) |
178.74 |
61.34 (3.69) |
31.86 (2.01,1.87) |
Cg , 26.60 (1.68,1.26); Cd , 29.57 (1.78,1.62); Ce , 41.95 (2.76 *) |
|
S25 |
113.77 (8.32) |
176.76 |
61.67 (4.21) |
62.76 (3.86, *) |
|
|
A26 |
125.20 (7.74) |
180.50 |
55.22 (4.11) |
17.91 (1.44) |
|
|
I27 |
118.31 (7.78) |
177.74 |
66.06 (3.25) |
37.86 (1.69) |
Cg 1, 28.53 (1.83, 0.36); Cg 2, 16.96 (0.30); Cd 1, 13.03 (0.41) |
|
E28 |
119.04 (8.77) |
179.12 |
60.18 (3.88) |
29.55 (2.09, 2.23) |
Cg , 37.40 (2.24 *) |
|
S29 |
112.96 (7.94) |
174.90 |
61.43 (4.23) |
63.27 (3.99, *) |
|
|
K30 |
118.09 (7.21) |
175.00 |
52.89 (4.47) |
32.05 (2.02,1.78) |
Cg , 22.85 (1.11,1.42); Cd , 27.40 (1.64,1.44); Ce , 42.06 (2.98,2.90) |
|
F31 |
122.61 (7.61) |
175.39 |
56.18 (4.40) |
39.62 (3.27,3.00) |
|
|
Y32 |
124.43 (7.93) |
175.76 |
59.13 (4.46) |
38.04 (3.00,2.89) |
|
|
D33 |
119.35 (8.28) |
176.03 |
53.34 (4.62) |
40.15 (2.67,2.48) |
|
|
A34 |
124.23 (8.16) |
178.90 |
54.94 (3.73) |
18.34 (1.03) |
|
|
S35 |
112.21 (8.39) |
176.43 |
60.85 (3.86) |
62.48 (3.72,3.69) |
|
|
S36 |
117.41 (7.72) |
174.34 |
60.14 (4.12) |
62.64 (3.54,3.50) |
|
|
Y37 |
119.08 (7.69) |
174.14 |
56.68 (4.48) |
39.43 (3.29,2.64) |
|
|
A38 |
121.75 (7.00) |
178.47 |
53.95 (3.82) |
17.89 (1.11) |
|
|
G39 |
111.06 (8.57) |
174.14 |
45.18 (4.16,3.56) |
||
|
K40 |
120.34 (7.83) |
174.43 |
54.71 (4.65) |
34.83 (2.08,1.81) |
Cg , 25.26 (1.36 *); Cd , 28.94 (1.65,1.55); Ce , 42.43 (2.98 *) |
|
T41 |
111.81 (8.13) |
173.25 |
60.83 (4.99) |
71.80 (3.81) |
Cg 2, 20.84 (0.92) |
|
C42 |
121.86 (8.58) |
173.63 |
56.58 (5.05) |
48.71 (2.96,2.53) |
|
|
T43 |
128.91 (8.92) |
172.85 |
62.48 (4.95) |
69.62 (3.62) |
Cg 2, 21.52 (1.04) |
|
L44 |
128.45 (9.13) |
174.52 |
52.89 (4.74) |
44.70 (1.65,1.06) |
Cg , 26.13 (1.60); Cd 1, 23.87 (0.57); Cd 2, 25.44 (0.53) |
|
R45 |
123.21 (9.12) |
175.26 |
54.63 (4.66) |
29.72 (1.70,1.58) |
Cg , 26.16 (1.36,1.10); Cd , 41.18 (3.08,2.93) |
|
I46 |
126.60 (8.89) |
173.01 |
59.89 (4.74) |
41.62 (1.69) |
Cg 1, 26.70 (1.62,1.17); Cg 2, 16.82 (0.83); Cd 1, 14.30 (0.83) |
|
K47 |
121.60 (7.86) |
175.40 |
55.26 (4.99) |
35.22 (1.73,1.58) |
Cg , 24.69 (1.40 *); Cd , 29.64 (1.52 *); Ce , 42.03 (2.78 *) |
|
L48 |
123.90 (8.12) |
177.14 |
53.19 (5.23) |
45.76 (1.65, *) |
Cg , 26.56 (1.86); Cd 1, 26.47 (0.96); Cd 2, 24.13 (0.87) |
|
A49 |
126.15 (9.02) |
50.31 (4.79) |
19.15 (1.59) |
||
|
P50 |
|
175.78 |
64.83 (3.21) |
31.08 (1.53, *) |
Cg , 27.00 (1.82,1.47); Cd , 50.27 (3.70,3.62) |
|
D51 |
111.79 (7.47) |
176.99 |
52.60 (4.34) |
39.90 (2.89,2.41) |
|
|
G52 |
109.03 (8.40) |
171.58 |
44.83 (3.25,4.07) |
||
|
M53 |
117.46 (7.37) |
175.76 |
56.56 (4.01) |
32.31 (2.50,2.36) |
Cg , 32.61 (2.07,1.80) |
|
L54 |
125.39 (8.58) |
176.25 |
55.21 (4.37) |
42.19 (1.75,1.31) |
Cg , 26.69 (1.30); Cd 1, 24.88 (0.79); Cd 2, 25.84 (0.68) |
|
L55 |
128.91 (8.92) |
177.53 |
55.75 (4.29) |
42.45 (1.49,1.40) |
Cg , 26.47 (1.62); Cd 1, 25.42 (0.79); Cd 2, 22.03 (0.79) |
|
D56 |
115.16 (7.72) |
179.43 |
53.55 (4.69) |
44.65 (2.68,2.23) |
|
|
I57 |
119.29 (7.90) |
172.21 |
59.56 (5.17) |
40.24 (1.87) |
Cg 1, 27.77 (1.35,0.76); Cg 2, 14.28 (0.77); Cd 1, 15.00 (0.64) |
|
K58 |
124.67 (8.31) |
52.65 (4.86) |
35.71 (1.73,1.64) |
Cg , 24.07 (1.32 *); Cd , 28.93 (1.61 *); Ce , 41.95 (2.92 *) |
|
|
P59 |
|
176.33 |
62.60 (4.71) |
31.67 (2.02,1.91) |
Cg , 27.37 (2.21,1.72); Cd , 50.44 (3.69,3.66) |
|
E60 |
123.66 (9.30) |
175.77 |
56.01 (4.48) |
31.51 (1.92,1.58) |
Cg , 36.95 (2.05 *) |
|
G61 |
107.03 (7.58) |
171.78 |
45.05 (3.99,4.16) |
||
|
G62 |
106.92 (8.28) |
174.67 |
43.80 (3.68,4.82) |
||
|
D63 |
122.61 (8.36) |
52.66 (4.80) |
43.61 (2.87,2.68) |
||
|
P64 |
|
178.96 |
65.92 (4.00) |
32.20 (2.31,1.97) |
Cg , 27.46 (2.14,2.00); Cd , 51.19 (4.27,3.78) |
|
A65 |
120.97 (7.88) |
180.94 |
55.18 (4.18) |
18.04 (1.63) |
|
|
L66 |
121.96 (8.72) |
178.56 |
57.53 (3.43) |
40.30 (1.87,1.41) |
Cg , 27.77 (1.29); Cd 1, 27.06 (0.82); Cd 2, 22.94 (0.75) |
|
C67 |
115.22 (9.01) |
176.53 |
56.18 (4.44) |
37.62 (2.99,2.52) |
|
|
Q68 |
118.56 (7.97) |
178.48 |
59.13 (3.85) |
28.19 (2.08, *) |
Cg , 33.57 (2.38 *); Ne 2, 112.30 (6.72,7.42) |
|
A69 |
123.24 (7.61) |
180.15 |
54.53 (3.99) |
18.57 (1.21) |
|
|
A70 |
122.38 (8.97) |
178.25 |
54.48 (3.46) |
17.79 (0.97) |
|
|
L71 |
118.44 (7.94) |
178.34 |
58.33 (3.60) |
41.87 (1.68,1.44) |
Cg , 26.97 (1.69); Cd 1, 25.32 (0.70); Cd 2, 24.57 (0.64) |
|
A72 |
119.11 (7.02) |
180.28 |
54.70 (3.88) |
17.64 (1.32) |
|
|
A73 |
119.92 (7.26) |
179.57 |
54.39 (3.83) |
18.88 (1.14) |
|
|
A74 |
118.28 (8.33) |
178.73 |
55.00 (3.63) |
18.23 (1.17) |
|
|
K75 |
113.56 (7.16) |
177.13 |
58.41 (3.91) |
32.48 (1.86,1.70) |
Cg , 25.59 (1.60,1.36); Cd , 29.18 (1.57 *); Ce , 41.90 (2.83 *) |
|
L76 |
116.80 (7.10) |
176.90 |
54.21 (4.33) |
43.64 (1.76,1.47) |
Cg , 26.24 (1.69); Cd 1, 25.49 (0.90); Cd 2, 22.10 (0.80) |
|
A77 |
121.65 (7.07) |
176.26 |
52.24 (3.93) |
20.02 (1.08) |
|
|
K78 |
123.24 (8.43) |
174.75 |
54.26 (4.43) |
31.49 (1.67,1.57) |
Cg , 24.31 (1.27,1.19); Cd , 28.67 (1.56 *); Ce , 42.09 (2.89 *) |
|
I79 |
129.56 (8.46) |
58.32 (3.92) |
37.15 (2.20) |
Cg 1, 28.44 (1.42,1.01); Cg 2, 17.47 (0.88); Cd 1, 11.71 (0.68) |
|
|
P80 |
|
175.09 |
61.99 (4.35) |
31.87 (2.28,1.86) |
Cg , 27.52 (1.84 *); Cd , 50.54 (3.69,3.19) |
|
K81 |
122.90 (8.34) |
54.70 (3.90) |
32.06 (1.67,1.54) |
Cg , 24.28 (1.21 *); Cd , 23.82 (1.40,1.28); Ce , 41.96 (2.86 *) |
|
|
P82 |
|
60.60 (3.65) |
30.53 (1.62,1.51) |
Cg , 27.21 (2.01,1.98); Cd , 49.87 (3.49 *) |
|
|
P83 |
|
175.17 |
63.87 (4.21) |
31.89 (2.21,1.93) |
Cg , 26.88 (2.10,1.71); Cd , 50.75 (3.29,2.61) |
|
S84 |
108.00 (6.73) |
56.16 (4.54) |
65.97 (4.09,3.88) |
||
|
Q85 |
|
177.51 |
58.56 (4.10) |
27.67 (2.14,2.02) |
Cg , 33.13 (2.44 *) |
|
A86 |
120.28 (8.27) |
180.36 |
54.96 (4.04) |
17.97 (1.32) |
|
|
V87 |
116.41 (7.38) |
179.40 |
66.26 (3.61) |
31.68 (1.69) |
Cg 1, 24.03 (0.86); Cg 2, 23.56 (0.76) |
|
Y88 |
121.38 (8.02) |
175.55 |
61.43 (3.93) |
37.10 (3.14,3.06) |
|
|
E89 |
114.60 (8.08) |
178.67 |
59.03 (3.31) |
29.02 (1.94, *) |
Cg , 36.01 (2.37 *) |
|
V90 |
116.50 (6.92) |
176.89 |
65.27 (3.56) |
31.85 (2.09) |
Cg 1, 21.89 (0.94); Cg 2, 20.61 (0.29) |
|
F91 |
115.88 (7.42) |
173.93 |
60.57 (4.11) |
39.36 (3.51,2.54) |
|
|
K92 |
117.66 (7.40) |
177.13 |
58.86 (4.08) |
31.39 (1.18,1.52) |
Cg , 23.87 (1.17,0.98); Cd , 29.57 (1.44,1.33); Ce , 41.97 (2.81,2.88) |
|
N93 |
115.13 (7.20) |
173.98 |
53.24 (5.06) |
37.99 (2.76,2.68) |
|
|
A94 |
126.21 (8.47) |
50.06 (4.78) |
21.38 (1.11) |
||
|
P95 |
|
175.96 |
61.06 (5.27) |
31.40 (1.75, *) |
Cg , 26.18 (2.05,1.94); Cd , 49.69 (3.58 *) |
|
L96 |
122.65 (9.07) |
174.78 |
53.95 (4.48) |
46.03 (1.61,1.40) |
Cg , 26.89 (1.49); Cd 1, 25.22 (0.91); Cd 2, 25.84 (0.78) |
|
D97 |
125.91 (8.68) |
174.40 |
53.94 (4.92) |
40.69 (2.44,2.26) |
|
|
F98 |
125.81 (9.08) |
172.60 |
58.34 (4.36) |
41.52 (3.04,2.52) |
|
|
K99 |
127.51 (7.56) |
52.58 (4.77) |
34.09 (1.49,1.39) |
Cg , 23.80 (1.10 *); Cd , 29.39 (1.38 *); Ce , 41.86 (2.70 *) |
|
|
P100 |
|
175.96 |
62.48 (3.90) |
31.92 (1.59,1.52) |
Cg , 27.24 (1.74,1.39); Cd , 50.07 (3.70,2.90) |
|
H101 |
120.61 (8.95) |
173.86 |
56.02 (4.36) |
30.25 (3.01,2.85) |
|
|
H102 |
125.48 (7.96) |
57.22 (4.31) |
30.21 (3.09,2.95) |